研究紹介
現在の研究テーマ
① がん細胞の栄養素に着目した新規核医学画像診断薬と治療薬(核医学セラノスティクス)の開発
本研究室では、がん細胞の栄養素であるアミノ酸、グルコース、脂肪酸に着目した核医学画像診断薬をこれまで開発してきました。これらの画像診断薬を応用し、がん細胞だけに放射線を照射し、正常組織に影響を与えにくい核医学治療薬の開発(核医学セラノスティクス:診断と治療を一体化する手法)にも取り組んでいます。今後は、栄養素のみならず、様々な薬物送達技術を用いたラジオセラノスティクス研究に着手していきたいと考えています。
担当学生:佐藤 翔 (D3)、姚 建偉 (D1)、山形 純大 (M2)、金子 陽菜乃 (M1)、甘利 颯一朗 (B4)
代表的な業績
- Kobayashi M, Mizutani A, Nishi K, et al. Difference in accumulation and the transport mechanism of L- and D-methionine in high- and low-grade human glioma cells. Nucl Med Biol. 2017:44:78-82. doi: 10.1016/j.nucmedbio.2016.09.003.
- Ono M, Okudaira H, Kobayashi M, et al. Assessment of amino acid/drug transporters for renal transport of [18F]fluciclovine (anti-[18F]FACBC) in vitro. Int J Mol Sci. 2017:17(10): pii:E1730. doi: 10.3390/ijms17101730.
- Nishii R, Higashi T, Kobayashi Met al. Diagnostic usefulness of an amino acid tracer, α-[N-methyl-11C]-methylaminoisobutyric acid (11C-MeAIB), in the PET diagnosis of chest malignancies. Ann Nucl Med. 2013:27(9):808-21. doi: 10.1007/s12149-013-0750-4
② 難治性細菌感染症イメージング法と放射線治療法の開発
抗菌剤等で治療が難しい緑膿菌や黄色ブドウ球菌等の薬物耐性菌等が原因で生じた全身の感染状態を把握できるイメージング法の確立を目指しています。その際、感染による形態的な変化が生じる炎症領域と、炎症が生じる前段階における細菌感染領域を区別することを目標にしています。この鑑別によって、形態変化が生じる前段階の細菌感染症を迅速に検出できるイメージング法の開発が可能となると考えています。加えて、放射線照射による細菌の機能変化も観察することにより、患者個々の画像診断や放射線治療に繋がることを期待しています。
担当学生:百瀬 友麻 (M2)、北川 実祐 (M1)、松井 志奈 (B4)
代表的な業績
- Mizutani A, Kondo A, Muranaka Y, et al. Application of [99mTc]Tc-GSA in the diagnosis of Staphylococcus aureus infections. Nucl Med Biol. 2025:146-147:109021. doi: 10.1016/j.nucmedbio.2025.109021.
- Nishiyama Y, Mizutani A, Kobayashi M, et al. Non-invasive mycobavterium avium detection using99mTc-GSA on single-photon emission comuputed tomography. Pharmaceutics. 2024:17(3):362. doi: 10.3390/pharmaceutics17030362.
- Muranaka Y., Matsue M., Mizutani A., et al. Evaluation of L-Alanine Metabolism in Bacteria and Whole-Body Distribution with Bacterial Infection Model Mice. Int. J. Mol. Sci. 2023:(24): 4775. doi: 10.3390/ijms24054775.
③ 薬物トランスポーターや薬物代謝に着目した核医学画像診断法による薬物治療効果判定法の開発
市販の放射性医薬品や核医学画像診断薬は、体内で薬物を細胞内に輸送する薬物トランスポーターの効果により、がん細胞等に取り込まれるとともに、細胞排泄されることを見出してきました 。また、これらの薬剤は、肝臓のCytochrome P450等の薬物代謝酵素により代謝を受けることも確認してきました 。これらの薬物トランスポーターや肝臓の薬物代謝酵素の活性によって、抗がん剤や分子標的薬といった薬物療法の治療効果は変化するため、これらの治療効果を薬物投与前に予測することを目的とした核医学画像診断薬を新たに開発しています。
担当学生:阿部 椋太郎 (M2)、金子 陽菜乃 (M1)、田中 文音 (B4)
代表的な業績
- Mizutani A, Kobayashi M, Kawai K, et al. Measurement of Hepatic CYP3A4 and 2D6 Activity Using Radioiodine-Labeled O-Desmethylvenlafaxine. Int J Mol Sci. 2022:23(19):11458.
- Kobayashi M, Mizutani A, Kawai K, et al. [131I]MIBG exports via MRP transporters and inhibition of the MRP transporters improves accumulation of [131I]MIBG in neuroblastoma. Nucl Med Biol. 2020:90-91:49-54. doi: 10.1016/j.nucmedbio.2020.09.004.
- Kobayashi M, Mizutani A, Kawai K, et al. Different efflux transporter affinity and metabolism of99mTc-2-methoxyisobutylisonitrile and99mTc-tetrofosmin for multidrug resistance monitoring in cancer. Pharm Res. 2018:36(1):18.
④ 放射線内照射(核医学治療法)と放射線外照射を用いたがんや細菌の治療効果増強法とアブスコパル効果の検討
我々はこれまで、放射線内照射(核医学治療法)に使われているNa131Iを用いた甲状腺がん治療や131I-MIBGを用いた神経芽腫の治療において、腎臓やがん細胞からの排泄を一時的に抑制する方法などで、これらの治療薬剤の治療効果を増強する手法(核医学画像診断薬及び核医学治療薬の体内動態制御法)を開発してきました。現在は、分子標的薬や抗酸化物質等との組み合わせにより、放射線内照射と放射線外照射の放射線治療効果を増強する手法の開発にも取り組んでいます。加えて、この治療効果増強により生じた体内の免疫活性効果によるがんの転移巣の治療効果の向上 (アブスコパル効果)にも取り組んでおります。放射線治療におけるアブスコパル効果とは、放射線照射範囲外のがんの縮小効果が認められる稀な現象と言われています。放射線治療によりがん細胞が殺傷されると、障害関連分子パターン (DAMPs)が放出し、体内の樹状細胞(白血球細胞の一種)が活性化します。放射線効果により死亡した細胞は、活性化した樹状細胞に貪食され、がん抗原となります。そのがん抗原が樹状細胞から提示され、体内の細胞障害性T細胞が活性化することでアブスコパル効果を引き起こすと言われています。本研究室では、2023年度に新たに立ち上げた研究内容として、このアブスコパル効果発生率を増加する手法の開発に取り組んでいます。
担当学生:佐藤 翔 (D3)、濱田 優奈 (M2)、半田 理莉香 (M2)、渡邊 大河 (M1)、宍戸 亜輪 (B4)
代表的な業績
- Sato K, Handa R, Yao J, et al. Release of HMGB1 from human-derived cancer and normal cells by internal targeted radiotherapy with131I-meta-iodobenzylguanidine. J Radiat Res. 2025;66(4):385-395. doi: 10.1093/jrr/rraf034.
- Sato K, Mizutani A, Kobayashi M, et al. A single high-dose irradiation changes accumulation of methotrexate and gene expression levels of SLC and ABC transporters in cancer cells. Front. Pharmacol. 2023:13:1069321. doi: 10.3389/fphar.2022.1069321
- Kobayashi M, Mizutani A, Kleinerman ES, et al. [131I]MIBG exports via MRP transporters and inhibition of the MRP transporters improves accumulation of [131I]MIBG in neuroblastoma. Nucl Med Biol. 2020:90-91:49-54. doi: 10.1016/j.nucmedbio.2020.09.004.
過去の研究テーマ
① 動物・臨床用核医学イメージングの画質改善や画像解析法に関する研究
本研究室では、動物用及び臨床用核医学画像の画質改善を目指した核医学イメージングの撮像法や画像再構成法の研究及び核医学画像を用いた画像解析法に取り組んできました 。
代表的な業績
- Kobayashi M, Innis RB, Fujita M et al. 11C-DPA-713 has much greater specific binding to translocator protein 18 kDa (TSPO) in human brain than does 11C-(R)-PK11195. J Cereb Blood Flow Metab. 2018;38(3):393-403.
- Kobayashi M, Matsunari I, Nishi K, et al. Stimultaneous acquisition of 99mTc and 123I-labeled radiotracers using a preclinical SPECT scanner with CZT detectors. Ann Nucl Med. 2016;30(4):263-71.
② 非侵襲的脳循環代謝測定法の開発
放射性酸素-15 (15O)標識ガス等を用いた脳PET検査において、脳虚血や脳梗塞といった脳血管病変等を検出可能な脳循環代謝測定を行うためには、実験中あるいは検査中に通常動脈採血を必要とします。その動脈採血を行わずに、脳PET画像の左右差を利用して脳血管病変等を検出する手法を新たに開発してきました 。また、15O標識ガスの代わりに液体状の15O標識人工赤血球を用いた新しい脳循環代謝測定薬剤や実験動物における簡便な脳循環代謝測定法の開発にも取り組んできました。
代表的な業績
- Kobayashi M, Kawai K, Okazawa H, et al. Cerebral oxygen metabolism of rats using injectable 15O-oxygen with a steady-state method. J Cereb Blood Flow Metab. 2012;32(1):33-40.
- Kobayashi M, Okazawa H, Kawai K, et al. Diagnosis of misery perfusion using noninvasive O-15 gas PET. J Nucl Med. 2006;47(10):1581-6.
③ 核医学画像診断薬の経鼻・経口投与による新しい生体機能測定法の開発
本研究室では、脳血液関門における薬物排泄機能により脳集積しにくい核医学画像診断薬を経鼻投与することで、脳血液関門の影響を受けずに核医学画像診断薬の脳集積を増加させることに成功しました。同様に、核医学画像診断薬を経口投与することで、消化管の吸収機能をイメージングで測定する手法も開発してきました。一例として、123I-MIBGを対象者に経口投与させることで、小腸に発現している有機カチオン性薬物トランスポーターによる吸収機能の違いを膀胱の集積差で確認可能な手法を確立しました(図)。カチオン性薬剤を投与する前に、123I-MIBGの経口イメージングを行うことで、抗がん剤等が関与する有機カチオン性薬物トランスポーターによる消化管吸収機能を事前に把握可能なため、抗がん剤等の効果予測判定が可能となります。
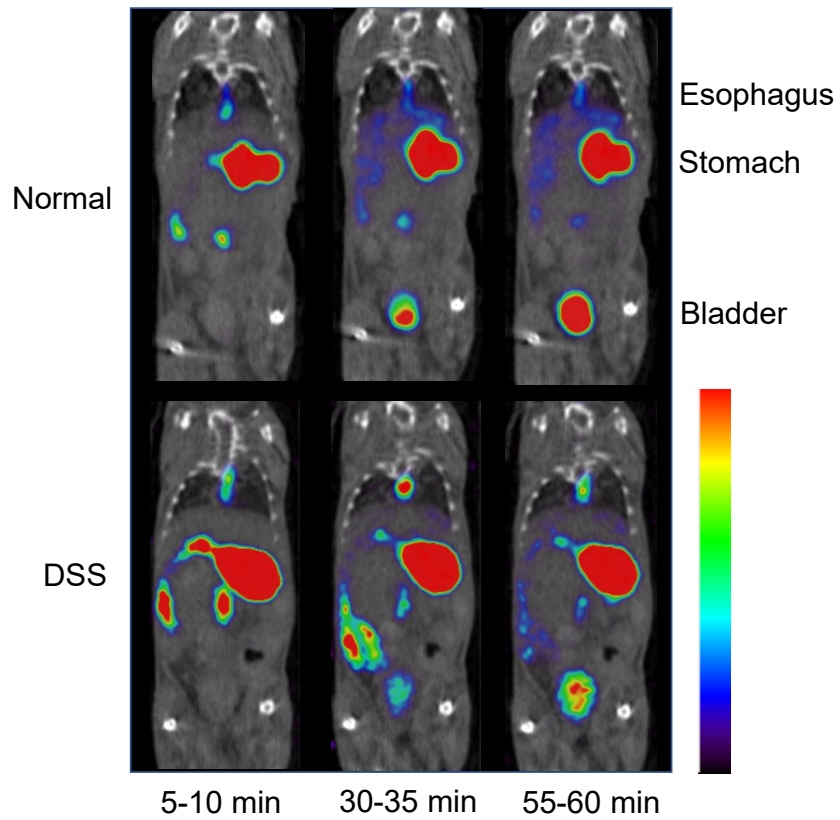
DSS:dextran sodium sulfate
上段は正常マウス
下段はDSSによる腸炎モデルマウス
代表的な業績
- Sato K, Mizutani A, Kobayashi M, et al. Biological distribution after oral administration of radioiodine-labeled acetaminophen to estimate gastrointestinal absorption function via OATPs, OATs and/or MRPs. Pharmaceutics. 2023;15(2):497.
- Kobayashi M, Mizutani A, Muranaka Y, et al. Biological distribution of orally administrated [123I]MIBG for estimation of gastrointestinal tract absorption. Pharmaceutics. 2021;14(1):61.